Rollingstone.co.id – Banyak aspek dalam kehidupan sehari-hari yang berkaitan erat dengan konsep pembelajaran kimia. Seperti proses pengaratan pada besi, proses pembuatan obat, proses pencucian baju, dan lain sebagainya. Salah satu contoh konsep kimia yang banyak diterapkan adalah konsep laju reaksi dalam proses kimia.
Tak bisa dipungkiri bahwa proses kimia banyak menggambarkan kehidupan sehari-hari. Bahkan dalam kebiasaan sederhana seperti melarutkan bahan tertentu pada air pun mengandung konsep dan pembelajaran kimia. Tak terkecuali laju reaksi yang berkaitan dengan perubahan reaksi zat dan konsentrasi per satuan waktu tertentu.
Konsep laju reaksi memiliki banyak manfaat dalam kehidupan sehari-hari. Contoh paling sederhana adalah ketika terjadi perubahan warna pada sebuah larutan yang dicampurkan dengan air yang terjadi dalam waktu tertentu yang cenderung cepat. Tak heran jika konsep laju reaksi banyak digunakan dalam berbagai industri.
Pengertian Laju Reaksi
Konsep laju reaksi memiliki definisi sebagai pereaksi atau hasil reaksi yang menggambarkan cepat lambatnya suatu reaksi kimia. Pereaksi merupakan laju penurunan reaktan atau proses mengubah suatu zat menjadi zat baru yang disebut dengan produk atau hasil reaksi.
Laju reaksi menyatakan cepat lambatnya suatu proses reaksi kimia berlangsung pada satuan waktu tertentu. Beberapa bahan akan mengalami reaksi kimia dengan cepat seperti natrium yang dimasukkan ke dalam air, petasan dan kembang api ketika disulut, atau bensin ketika terbakar.
Selain itu, terdapat pula bahan-bahan yang mengalami reaksi lambat seperti proses pengaratan pada besi atau reaksi kimia pada tubuh. Cepat lambatnya proses reaksi tersebut kemudian dipelajari dalam laju reaksi agar bisa menentukan besaran konsentrasi yang dinyatakan dengan molaritas pada setiap satuan waktu.
Satuan molaritas dinyatakan sebagai satuan konsentrasi pada materi tertentu dalam laju reaksi. Satuan ini menyatakan berapa banyak jumlah mol zat dalam 1 liter larutan. Molaritas sendiri dinotasikan dalam huruf M dan dinyatakan dalam rumus sederhana sebagai berikut:
M = n/VKeterangan
M = molaritas
V = volume dalam satuan liter (L) atau mililiter (mL)
N = jumlah mol dalam satuan mol atau mmol
Pengertian Menurut Para Ahli
Selain definisi umum di atas, beberapa ahli juga mengungkapkan pendapatnya terkait pengertian laju reaksi seperti berikut:
-
Dedi Gunanto, 2018
Laju reaksi merupakan suatu perubahan konsetrasi zat pada suatu reaksi kimia tertentu per satuan waktu yang dipengaruhi oleh sifat kimia peraksi, suhu, konsentrasi pereaksi, katalis dan tekanan, serta luas permukaan sentuh.
-
Nurhayati Rahayu & Jodhi Pramuji Giriarso, 2010
Laju reaksi adalah perubahan konsentrasi zat yang dapat berkurang seiring bertambahnya konsentrasi produk dalam suatu reaksi per satuan waktu yang dilambangkan dengan huruf V dan memiliki satuan molar/detik.
Teori Laju Reaksi
Setiap rumus dalam konsep kimia memiliki teori yang membahasnya termasuk konsep laju reaksi kimia yang dibahas dalam teori tumbukan. Teori ini menyatakan bahwa “suatu proses reaksi kimia dapat berlangsung jika hasil tumbukan antar partikel zat pereaksi memiliki energi yang cukup dan arah tumbukan yang tepat.”
Proses terjadinya tumbukan tersebut dipengaruhi oleh faktor-faktor seperti konsentrasi reaktan, luas permukaan, katalis, dan suhu. Teori tumbukan ini menyatakan beberapa fakta sebagai berikut:
- Luas permukaan (luas bidang sentuh) berbanding lurus dengan laju reaksi. Suatu bidang dengan permukaan yang halus dan luas akan memperbanyak terjadinya tumbukan sehingga mempercepat laju reaksi. Sebaliknya benda yang permukaannya kasar dan sempit akan memperlambat laju reaksi.
- Konsentrasi reaktan merupakan salah satu faktor laju reaksi yang memiliki perbandingan lurus terhadap laju reaksi. Ketika konsentrasi reaktan semakin besar, maka semakin proses reaksinya pun berlangsung cepat. Sebaliknya semakin kecil konsentrasi reaktan maka semakin lambat proses laju reaksinya.
- Katalis merupakan zat yang dapat mempercepat reaksi karena dapat menurunkan energi aktivasi. Ketika jumlah katalis bertambah maka reaksi menjadi cepat karena tumbukan bertambah.
Sebagai contoh, senyawa feri klorida FeCl3 yang menguraikan H2O2 (hydrogen peroxide) menjadi H2O (hidrogen) dan O2 (oksigen).
- Suhu berbanding lurus dengan laju reaksi di mana ketika suhu semakin tinggi maka dapat mempercepat laju reaksi. Hal ini dikarenakan bertambahnya jumlah molekul yang mencapai energi aktivasi karena energi energi kinetik rata-rata partikel reaktan semakin besar.
Pengaruh faktor-faktor tersebut di atas dengan laju reaksi dapat dilihat pada contoh grafik berikut.
Rumus dan Persamaan Laju Reaksi
Seperti dijelaskan di atas, laju reaksi merupakan perubahan jumlah molar zat per satuan waktu yang secara sederhana dinyatakan dalam rumus M = n/V. Secara lebih detail dan terperinci, konsep laju reaksi juga bisa dinyatakan dalam rumus sebagai berikut:
Keterangan:
Δ[x]/M = perubahan konsentrasi molar zat (molaritas)Δt = perubahan waktu (s)
V = volume larutan/ruangan gas (L atau mL)
n = jumlah mol zat terlarut (mol)
v = laju reaksi (M/s)
Berdasarkan rumus tersebut, maka bisa dinyatakan bahwa laju reaksi akan semakin kecil nilainya jika terjadi faktor berikut:
- Jumlah reaktan berkurang sehingga lama-kelamaan bernilai nol (reaksi selesai)
- Jumlah produk bertambah dan bernilai tetap (reaksi selesai)
Laju reaksi kimia yang dirumuskan dalam rumus matematis tersebut dapat dijelaskan secara rinci dengan diagram konsentrasi dan penjelasan sebagai berikut:
Saat proses reaksi kimia A –> B, maka perubahan yang terjadi pada zat B ditentukan dari jumlah zat A yang beraksi dan jumlah zat B yang terbentuk. Proses terjadinya perubahan tersebut terjadi per satuan waktu tertentu. Peraksi dan reaksi memiliki hubungan berbanding terbalik di mana saat A berkurang, maka B akan bertambah.
Jika dilihat dalam diagram hubungan konsentrasi pereaksi dan hasil reaksi, maka dapat diambil rumus yang lebih kompleks dan detail sebagai berikut:
a. Jumlah peraksi yang berkurang (konsentrasi pereaksi) per satuan waktu, maka rumusnya menjadi:
‘ Δt
Atau rA= – Δ (A)
‘ Δt
Untuk menyatakan laju berkurangnya zat A pada reaksi A –> B
Keterangan:
r = laju reaksi
– Δ (R) = berkurangnya reaktan (pereaksi)
Δt = perubahan waktu
b. Jumlah produk atau hasil reaksi (konsentrasi produk) per satuan waktu, maka rumusnya menjadi:
r = + Δ (P)
‘ Δt
Atau
rB= – Δ (B)
‘ Δt
Untuk menyatakan laju berkurangnya zat B pada reaksi A –> B
Keterangan:
r = laju reaksi
+ Δ (P) = bertambahnya hasil reaksi (konsentrasi produk)
Δt = perubahan waktu
Jika terjadi reaksi yang lebih kompleks dan tidak sederhana seperti pA + qB à Rc, maka rumusnya pun menjadi lebih kompleks seperti berikut:
‘ Δt Δt Δt
Untuk reaksi kimia yang lebih komplek, maka tidak perlu ditambahkan tanda “+” dan tanda “–“ karena hanya menunjukkan sifat perubahan konsentrasi. Perbandingan laju reaksi berbanding lurus dengan perbandingan konsentrasi reaktan karena nilai delta t masing-masing sama.Selain itu, konsentrasi juga berbanding lurus dengan mol dan koefisien reaksi. Sehingga dapat disimpulkan bahwa perbandingan laju reaksi juga sebanding dengan koefisien reaksi. Jika dituliskan dalam rumus matematis, maka menjadi:
Proses reaksi yang lebih kompleks mengandung lebih dari satu reaktan. Sebagai contoh, jika reaksi mengandung reaktan A dan reaktan B maka akan membentuk produk C dan D. Reaktan dan produk memiliki perbandingan terbalik.
Di mana reaktan A dan B akan memiliki jumlah molekul yang semakin lama semakin berkurang. Sedangkan pada produk C dan D akan terjadi sebaliknya yaitu jumlah molekul yang semakin bertambah. Rumus persamaan laju reaksi tersebut bisa dinyatakan seperti berikut:
αA + bB à cC + dD
| Δ(A) = (A)2 – (A)1 , dengan t2 > t1 Δt t2 – t1v = – 1 Δ(A) = – 1 Δ(B) = + 1 Δ(C) = + 1 Δ(D) ‘ α Δt b Δt c Δt d Δt |
Dalam rumus tersebut, laju reaksi tersebut memiliki reaktan A dan B yang mengalami perubahan konsentrasi, sehingga diberi tanda negatif agar nilainya menjadi positif. Sedangkan untuk laju reaksi sendiri merupakan besaran yang harus selalu memiliki nilai positif yang dinyatakan dalam satuan mol L-1 s-1 atau M s-1.
Selain rumus-rumus tersebut di atas, terdapat pula beberapa contoh reaksi dan rumus laju reaksi dari hasil suatu eksperimen sebagai berikut:
| Reaksi | Rumus Laju Reaksi Hasil Eksperimen |
| 2 H2(g) + 2 NO (g) à 2 H2 O(g) + N2(g) | r = k . (H2) (NO)2 |
| H2(g) + I2(g) à 2 HI(g) | r = k . (H2) (I2) |
| 2 HI(g) à H2(g) + I2(g) | r = k . (HI2) |
| 2 H2(g) + SO2(g) à 2 H2 O(g) + S(g) | r = k . (H2) (SO2) |
| 2 H2O2(a) à 2 H2 O(I) + O2(g) | r = k . (H2O2)2 |
Selain itu, persamaan laju reaksi yang memiliki hubungan dengan molaritas dapat dinyatakan dalam persamaan seperti berikut ini:
Keterangan:
k = Konstanta/tetapan laju reaksi
n = Orde/tingkat reaksi terhadap zat B
m = Orde/tingkat reaksi terhadap zat An = m = orde reaksi total
Orde Laju Reaksi
Orde reaksi merupakan istilah yang sering ditemukan dalam persamaan laju reaksi dan dinyatakan dalam bentuk pangkat konsentrasi yang menunjukkan tingkat reaksi suatu zat. Orde reaksi ini ditentukan dari data eksperimen dan bukan dari koefisien reaksi.
Nilai orde reaksi total merupakan penjumlahan orde reaksi seluruh zat reaktan yang bisa dinyatakan dalam bilangan positif, negatif, nol, maupun pecahan. Berikut ini contohnya:
v = k (A), orde reaksi total = 0
(B)
v = k (A)2(B), orde reaksi total = 3
v = k (A)-2(B)1, orde reaksi total = – 1
Dalam sebuah proses laju reaksi, terdapat beberapa orde dalam proses tersebut yang menyatakan besarnya pengaruh konsentrasi reaktan. Berikut ini beberapa orde dalam laju reaksi, di antaranya adalah:
-
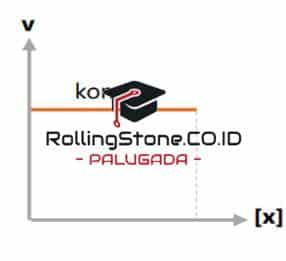
Orde Reaksi Nol
Orde reaksi nol merupakan orde laju reaksi yang mana reaktan ini tidak dipengaruhi oleh perubahan konsentrasi reaksinya. Sehingga laju reaksi tidak akan terpengaruh sama sekali terhadap perubahan konsentrasi reaktan meskipun memiliki jumlah tertentu.
Besar laju reaksi sendiri hanya akan dipengaruhi oleh konstata laju reaksinya (k). Hal tersebut bisa dilihat dalam rumus dan diagram berikut ini:
-
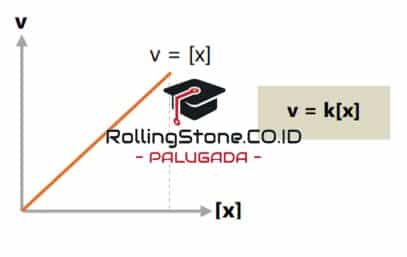
Orde Reaksi Satu
Orde reaksi satu memiliki perbandingan lurus antara laju reaksi dengan konsentrasi reaktannya. Sehingga jika konsentrasi reaktan tersebut dilipatgandakan, maka besar laju reaksi akan menjadi lebih besar 2 kali atau menjadi 21. Orde reaksi satu dinyatakan dalam rumus dan diagram berikut:
-
Orde Reaksi Dua
Orde reaksi dua merupakan suata reaktan yang memiliki laju reaksi pangkat dua dari konsentrasi reaktan tersebut. Artinya jika konsentrasi reaktannya dilipatgandakan, maka besar laju reaksinya menjadi 4 kali lebih besar atau menjadi 22. Orde reaksi dua dinyatakan dalam rumus dan diagram sebagai berikut:

Konstanta Laju Reaksi
Istilah lain yang sering ditemukan dalam persamaan laju reaksi adalah konstanta laju reaksi yang dinotasikan dalam huruf “k”. Konstanta laju reaksi merupakan suatu tetapan yang sangat dipengaruhi pada jenis suhu, pereaksi, dan katalis yang nilainya berbanding terbalik dengan perubahan waktu.
Jika suatu reaksi semakin cepat berlangsung waktunya, maka nilai “k” semakin besar dan sebaliknya. Begitupun halnya yang terjadi pada perbandingan perubahan suhu di mana nilai konstanta laju reaksi atau nilai “k” akan semakin besar jika suhu reaksi semakin tinggi.
Faktor-faktor yang mempengaruhi konstanta laju reaksi dibagi ke dalam beberapa variabel, di antaranya:
- Variabel manipulasi/bebas merupakan variabel yang dapat diubah dalam percobaan atau eksperimen. Contoh: konsentrasi zat (faktor konsentrasi) dan ukuran keping pualam (faktor luas permukaan).
- Variabel terkontrol merupakan variabel yang dibuat tetap dalam seluruh percobaan atau eksperimen. Contoh: suatu percobaan yang mengubah konsentrasi larutannya yang mana jenis larutannya tetap meskipun konsentrasinya berubah.
- Variabel terikat/respons merupakan variabel hasil dari suatu eksperimen. Contoh: melakukan percobaan atau eksperimen untuk mengukur faktor-faktor yang dapat mempengaruhi laju reaksi dengan hasil analisis data pada tiap-tiap uji coba tersebut berdasarkan variable faktor yang dibuat.
Faktor yang Mempengaruhi Laju Reaksi
Dalam proses perubahan suatu reaksi kimia, laju reaksi sendiri bukan hanya sekedar transformasi dari satu zat ke zat lainnya. Namun, laju reaksi juga dipengaruhi oleh banyak faktor sebagai berikut:
-
Suhu

Pengaruh suhu terhadap laju reaksi memiliki hubungan yang berbanding lurus. Ketika suhu reaksi naik maka partikel penyebab tumbukan semakin aktif bergerak sehingga laju reaksi semakin besar. Sebaliknya ketika suhu diturunkan maka laju reaksi semakin lambat karena gerakan partikel tidak akan aktif.
-
Konsentrasi Reaktan
Konsentrasi reaktan merupakan salah satu faktor laju reaksi yang memiliki hubungan yang berbanding lurus dengan laju reaksi. Di mana semakin tinggi konsentrasi reaktan, maka semakin cepat laju reaksinya karena semakin banyak partikel yang bertumbukan.
Contoh nyata dalam kehidupan sehari-hari seperti reaksi besi di udara yang lembab memiliki laju reaksi korosi yang lebih tinggi dibandingkan di udara panas. Hal ini dikarenakan jumlah konsetrasi reaktan H2O-nya tinggi sehingga berpengaruh terhadap proses laju reaksi pengaratan besi tersebut.
-
Tekanan
Besarnya laju reaksi juga dipengaruhi oleh tekanan dengan teori yang berbanding lurus. Semakin tinggi jumlah tekanan yang ditambahkan, maka konsentrasi reaktan akan semakin besar dan volume semakin kecil sehingga nilai laju reaksi pun semakin besar.
-
Katalis
Katalis merupakan suatu zat yang dapat mempercepat laju reaksi kimia tanpa mengalami perubahan oleh reaksi itu sendiri tergantung dari suhu tempat terjadinya reaksi. Meskipun dpaat mempengaruhi cepat lambat laju reaksi, katalis bukan termasuk sebagai pereaksi maupun hasil reaksi (produk).
Katalis hanya dapat memicu perubahan terhadap perekasi yang memungkinkan reaksi menjadi berlangsung lebih cepat maupun lebih lambat. Katalis dapat mengurangi energi aktivasi yang dibutuhkan agar reaksi dapat berlangsung.
-
Luas permukaan sentuh
Luas permukaan sentuh berbanding lurus dengan laju reaksi dan merupakan salah satu faktor yang memiliki peran sangat penting dalam menentukan cepat lambatnya laju reaksi. Semakin luas dan besar permukaan suatu bidang sentuh antar partikel, maka laju reaksi semakin cepat karena tumbukan semakin banyak.
Sebaliknya, semakin sempit dan kecil permukaan bidang sentuh antar partikel, maka semakin lambat laju reaksinya karena tumbukan semakin kecil. Karakter atau tekstur suatu bidang sentuh juga dapat mempengaruhi cepat lambatnya laju reaksi.
Jika tekstur dan karakteristik bidang sentuh tersebut semakin halus, maka laju reaksi pun semakin cepat. Sedangkan jika karakteristik bidang sentuh semakin kasar, maka semakin lama laju reaksi yang dibutuhkan untuk menyelesaikan proses reaksi tersebut.
Manfaat Laju Reaksi dan Contoh Penerapannya
Teori laju reaksi banyak dimanfaatkan oleh para pelaku industri karena dinilai memiliki banyak manfaat untuk efektivitas dan efisiensi produksi. Sehingga dalam setiap proses produksi yang dilakukan dapat diatur setiap faktor yang mempengaruhi laju reaksi mulai dari konsentrasi hingga luas bidang sentuh.
Selain itu, dalam proses pembuatan suatu benda di suatu industri tentu sangat berpengaruh terhadap variabel bahan-bahan yang dibutuhkan. Variabel tenaga dan waktu pun sangat penting untuk ditentukan karena akan berkaitan dengan biaya atau budget yang dibutuhkan dalam proses produksi tersebut.
Dalam kehidupan sehari-hari pun laju reaksi juga banyak memberikan manfaat untuk mempermudah pekerjaan. Bahkan dalam prakteknya pun sangat dekat dengan kehidupan sehari-hari. Berikut ini contoh penerapan teori laju reaksi dalam aktivitas pekerjaan sekaligus penjelasannya, di antaranya:
- Pedagang bubur kacang mengiris gula merahnya terlebih dahulu sebelum dimasukkan ke dalam bubur kacang. Contoh ini menerapkan faktor karakteristik bidang sentuh di mana semakin halus suatu bidang sentuh maka akan semakin cepat laju reaksinya.
- Membakar kayu yang sudah dibelah-belah terlebih dahulu sebelum dimasukkan ke dalam tungku. Hal ini dikarenakan jika kayu tersebut dibiarkan besar dalam bentuk gelondongan, maka proses pembakaran api akan lebih lama dibandingkan jika dipotong terlebih dahulu.
- Industri pabrik kertas akan menggerus bahan bakunya terlebih dahulu dan menjadikannya bubur kertas. Tujuannya agar luas permukaan bidang sentuh semakin luas sehingga campuran menjadi homogen dan proses laju reaksi pun semakin cepat.
- Menambahkan ragi yang memiliki fungsi sebagai katalis untuk mempercepat laju reaksi untuk pembuatan tape, tempe, dan roti, maka biasanya akan ditambahkan ragi.
Contoh Percobaan dalam Laju Reaksi
Untuk membuktikan bagaimana proses laju reaksi terjadi pada suatu bahan-bahan tertentu, contoh eksperimen berikut ini bisa dipraktekkan di rumah. Perbedaan reaksi terhadap beberapa faktor yang mempengaruhi laju reaksi dalam kondisi tertentu juga dapat dilihat dalam tabel di bawahnya.
Alat yang dibutuhkan:
Tabung reaksi, rak tabung reaksi, stopwatch, kertas HVS, gelas beaker 100 mili liter, water bath, termometer, pipet tetes, neraca ohaus, gelas ukur, alu dan mortar, spatula, cawan petri, penjepit kayu, dan spidol.
Bahan yang dibutuhkan:
Pita magnesium, HCl 0.1M, HCL 0.5M, HCL 1M, HCL 2M, HCL 3M, Na2S2O3, NaCI 0.1M, FeCI3 0.1M, H2O2, marmer serbuk, dan marmer bongkahan.
Metode kerja:
Percobaan ini dilakukan dengan metode dan langkah kerja sebagai berikut ini:
- Siapkan tabung reaksi dan beri nomor 1, 2, 3, dan 4
- Masukkan potongan magnesium ukuran 0.5 cm ke masing-masing tabung
- Masukkan masing-masing pereaksi yang mempengaruhi laju reaksi berupa konsentrasi reaktan, suhu, katalis, dan luas permukaan bidang
- Lihat reaksi yang berbeda pada setiap eksperimen yang dilakukan
Analisa Data:
Kesimpulan dari langkah kerja eksperimen tersebut di atas bisa dilihat pada hasil analisa data berikut ini:
- Faktor konsentrasi reaktan
| NO | Reaksi | Waktu | Hasil Analisa |
| 1 | Pita Mg + 1ml HCl 0.5M | 234 | Gelembung banyak |
| 2 | Pita Mg + 1ml HCl 1M | 104 | Gelembung sedang + beruap |
| 3 | Pita Mg + 1ml HCl 2M | 28 | Gelembung sedikit + beruap |
| 4 | Pita Mg + 1ml HCl 3M | 11 | Gelembung sangat sedikit + tabung panas |
Hasil reaksi : Mg(s) + 2HCl(aq) à MgCl2(aq) + H2(g)
Dari hasil analisa tersebut jelas terlihat bahwa semakin banyak jumlah konsentrasi yang ditambahkan, maka semakin cepat laju reaksi yang terjadi. Hal ini berkaitan dengan jumlah partikel yang semakin rapat pada larutan dengan konsentrasi yang tinggi sehingga menjadi lebih sering bertumbukan.
- Faktor suhu
| NO | Reaksi | Suhu | Waktu | Hasil Analisa |
| 1 | HCl 15ml + Na2S2O3 15ml | 29oC | 170 | berwarna putih susu + berbau |
| 2 | 40oC | 122 | Berwarna putih susu + berbau | |
| 3 | 50oC | 107 | Berwarna putih susu + berbau | |
| 4 | 60oC | 52 | Berwarna putih susu + berbau |
Hasil reaksi : Na2S2O3(aq) + HCl(aq) à SO2(g) + S(s) + 2NaCl(aq) + H2O
Dari hasil pengamatan di atas terlihat bahwa suhu turut berperan dalam mempengaruhi laju reaksi. Semakin tinggi suhu tersebut, maka semakin cepat laju reaksinya karena partikel-partikel yang ada semakin aktif bergerak. Sehingga bisa dikatakan bahwa hasil analisa ini sesuai dengan teori yang ada.
- Faktor luas permukaan bidang sentuh
| NO | Reaksi | Waktu | Hasil Analisa |
| 1 | 5ml HCl 2M + bubuk marmer dari batu marmer yang dihaluskan | 209 detik | Gelembung banyak + reaksi cepat |
| 2 | 5ml HCl 2M + bongkahan batu marmer | 1572 detik | Gelembung sedikit + reaksi lambat |
Hasil reaksi : CaCO3(s) + 2HCl(aq) à CaCl2(s) + H2O(aq) + CO2(g)
Pada percobaan di atas, terlihat bahwa batu marmer yang telah dihaluskan menjadi bubuk ternyata ebih cepat bereaksi dibandingkan dengan batu bongkahan. Hal ini dikarenakan bongkahan zat padat memiliki luas permukaan yang lebih kecil dibandingkan bubuk batu marmer.
Masing-masing molekul bidang sentuh mengalami tumbukan dengan luas permukaan bidang yang ada. Ketika ukuran partikel zat semakin kecil maka permukaan zat tersebut semakin luas sehingga reaksi terjadi dengan lebih cepat. Sebaliknya, jika ukuran semakin besar maka permukaan zat semakin sempit.
- Faktor katalis
| NO | Reaksi | Hasil Analisa |
| 1 | 5ml H2O2 | Sebagai kontrol |
| 2 | 5ml H2O2 + 4 tetes NaCl 0.1M | Gelembung banyak |
| 3 | 5ml H2O2 + 4 tetes FeCl3 0.1M | Terbentuk 2 lapisan yaitu coklat tua dan bening di awal. Kemudian menyatu dan berubah menjadi coklat muda. Selain itu, keluar asap dari tabung karena mendidih dan tabung reaksi menjadi panas. |
Melalui percobaan tersebut diketahui bahwa sifat katalis seperti enzim dan hanya bekerja pada senyawa tertentu. Dari dua jenis katalis yang digunakan yaitu NaCl dan FeCl3, yang paling cocok untuk bereaksi dengan H2O2 adalah FeCl3.
Contoh Soal Laju Reaksi
Untuk lebih mudah dalam mempelajari penggunaan rumus laju reaksi, contoh-contoh soal laju reaksi berikut ini bisa menjadi referensi untuk belajar.
Soal 1:
Tentukan rumus laju reaksi dari sebuah reaksi senyawa yang memiliki persamaan 2N2O5 à 4NO2 + O2!
v = – Δ(R) atau v = + Δ(P)
‘ Δt Δt
Keterangan:
Δ(P) = produk
Δ(R) = reaktan
Δt = waktuBerdasarkan soal di atas, maka rumus laju reaksinya menjadi sebagai berikut:
v N2O5 = – ΔN205 m.det
‘ Δt
v NO2 = + ΔNO2 m.det
‘ Δt
v O2 = + ΔO2 m.det
‘ Δt
Soal 2:
Pada suatu eksperimen dengan reaksi 2NO + Br2 –> 2NOBr ditemukan data seperti berikut ini:
|
Eksperimen |
(NO) (M) |
(Br2) (M) |
V (M.s-1) |
|
1 |
0,1 | 0,1 | 10 |
| 2 | 0,2 | 0,1 |
20 |
| 3 | 0,3 | 0,2 |
120 |
Maka tentukan persamaan laju reaksi di atas!
Penyelesaian:
Gunakan data eksperimen yang memuat konsentrasi Br2 dengan nilai tetap yaitu pada eksperimen 1 dan 2 untuk mencari orde reaksi NO. Persamaan yang diperoleh adalah sebagai berikut:
V2 k (NO)2X . (Br2)2y
20 = (0,4)x
2 maka x = 1
Untuk mencari orde reaksi Br2 sendiri bisa menggunakan eksperimen yang mana saja.
V3 k (NO)2X . (Br2)2y
20 = (0,3)x . (0.2)y
12
12
1 = (1/2), maka y = 2
4
Sehingga persamaan lajunya adalah sebagai berikut:
Menyelesaikan persamaan kimia memang terbilang cukup rumit, namun bagaimanapun juga konsep kimia sangat dekat dengan kehidupan sehari-hari. Sehingga dengan mempelajari laju reaksi maka akan sangat mudah untuk menentukan faktor-faktor tertentu yang berpengaruh pada proses produksi.
Dengan memahami laju reaksi dengan baik, maka beberapa masalah produksi maupun aktivitas sehari-hari yang berkaitan dengan teori ini bisa diselesaikan dengan mudah. Sehingga diharapkan segala aktivitas dapat berjalan dan dikerjakan dengan lebih efektif dan efisien.
Baca juga:
- Arti Diksi Adalah, Contoh Diksi, Fungsi, Jenis, Syarat, Ciri
- Makna Pancasila Sebagai Dasar Negara dan Kedudukannya
- Arti Pancasila sebagai Ideologi Terbuka dan Contohnya
- Makna Pancasila Sebagai Pandangan Hidup Bangsa dan Artinya
Situs Yang Berhubungan Dengan Materi Diatas :
- https://rollingstone.co.id/
- https://www.gurupendidikan.co.id/
- https://www.dosenpendidikan.co.id/
- https://www.kuliahbahasainggris.com/
- https://www.sekolahbahasainggris.co.id/
- https://www.ilmubahasainggris.com/
- https://www.dulurtekno.co.id/
- https://teknosentrik.com/
- https://www.mobifrance.com/
- https://minglebox.com/
- https://mozillalinks.org/
- https://dreamprojections.com/
- https://memphisthemusical.com/
- https://officialjimbreuer.com/
- https://timeisillmatic.com/
- https://votizen.com/
- https://boutiquevestibule.com/
- https://ariatemplates.com/
- https://worldbeforeher.com/
- https://thinknext.net/
- https://bootb.com/
- https://excite.co.id/
- https://hargaburung.id/
- https://www.dosenmatematika.co.id/
- https://merekbagus.co.id/
- https://ngelag.com/
- https://www.sudoway.id/
- https://www.caramudahbelajarbahasainggris.net/
- https://www.kakakpintar.id/
- https://www.belajarbahasainggrisku.id/
- https://ruangseni.com/
- https://exposicionesmapfrearte.com/
- https://duniapendidikan.co.id/
- https://pendidikan.co.id/
- https://pengajar.co.id/
- https://www.ayoksinau.com/
- https://pakdosen.co.id/
- https://dolanyok.com/
- https://newsinfilm.com/
- https://daftarpaket.co.id/
- https://voi.co.id/
- https://merkbagus.id/
- https://www.i4startup.id/
- https://ekosistem.co.id/
- https://laelitm.com/
- https://4winmobile.com/
- https://fiskal.co.id/
- https://inibiodata.com/
- https://giztech.id/